Chemie
Hier sollt Ihr Euch immer alle möglichen Sachen für die Schulchemie anschauen können, und es soll Euch beim lernen helfen.
Periodensystem der Elemente
Laborgeräte
Becherglas
Erlen-Meyer-Kolben
Benannt nach Emil Erlenmeyer, der ihn 1860 erfunden hat. Emil Erlenmeyer war ein Deutscher Chemiker, er hat von 1825 bis 1909 gelebt. Der Erlenmeyerkolben hat den Vorteil, dass die Wahrscheinlichkeit, dass beim Schwenken etwas unbeabsichtigt entweichen kann, kleiner ist, als bei anderen Gefäßen.
Messzylinder
Reagenzglas

Tiegelzange

Verbrennungslöffel
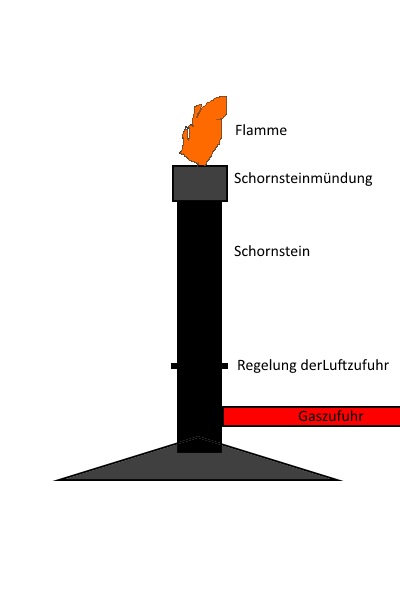
Der Gasbrenner
Berechnungen
1.Atommasse
a)Relative Atommasse
b)Absolute Atommasse
Die absolute Atommasse ist die wirkliche Masse eines Atoms und wird in Gramm angegeben. Sie liegt zwischen 10-24 und 20-22 Gramm
2.Mol
Ein Mol enthält 6 ⋅ 1023 Teilchen. Dabei kann es sich um Atome, Moleküle, Ionen, Elektronen oder Photonen handeln.
3.Molare Masse
Die molare Masse ist der Quotient aus der Masse einer Stoffprobe und der dazugehörigen Stoffmenge.
Molares Volumen
Das molare Volumen gibt an wie viel Volumen ein Mol eines Stoffes einnimmt.
Das molare Volumen unter Normbedingungen(101,325kPa;0°C) beträgt22,414
Lösen stöchometrischer Aufgaben
Beispiel: Berechnung der Masse an Magnesium, um 15g Magnesiumoxid herzustellen.
1.Reaktionsgleichung
2Mg + O2 → 2MgO
2.gegeben und gesucht
geg.: mMgO=15g ges.: mMg
3.allgemeine Größengleichung
mMg=
mMg=9g
Antwortsatz
A.: Das Magnesium muss eine Masse von 9g haben, um 15g Magnesiumoxid herstellen zu können.